Alcanos: Uma Abordagem Detalhada: Apresente As Principais Características Dos Alcanos E Forneça 2 Exemplos
Apresente As Principais Características Dos Alcanos E Forneça 2 Exemplos – Os alcanos, também conhecidos como parafinas, são hidrocarbonetos alifáticos saturados, ou seja, compostos orgânicos formados apenas por átomos de carbono e hidrogênio, unidos por ligações simples. Sua importância se estende por diversas áreas, desde a indústria petroquímica até o nosso dia a dia, estando presentes em combustíveis, plásticos e outros produtos essenciais. Vamos explorar suas características principais, desde a estrutura molecular até suas aplicações.
Introdução aos Alcanos
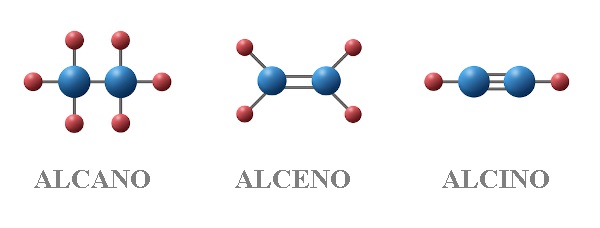
A estrutura química básica dos alcanos é caracterizada por cadeias de átomos de carbono, ligados entre si por ligações covalentes simples (ligações sigma, σ), e cada átomo de carbono restante ligando-se a átomos de hidrogênio, completando sua valência (quatro ligações). Essas ligações sigma são ligações fortes e relativamente estáveis, contribuindo para a baixa reatividade dos alcanos. A fórmula geral dos alcanos é CnH2n+2, onde ‘n’ representa o número de átomos de carbono na molécula.
Comparando com outros hidrocarbonetos, como os alcenos (CnH2n) e os alcinos (CnH2n-2), percebemos que os alcanos possuem um maior número de átomos de hidrogênio para o mesmo número de átomos de carbono, refletindo sua saturação.
Propriedades Físicas dos Alcanos
As propriedades físicas dos alcanos, como ponto de ebulição e ponto de fusão, variam sistematicamente com o aumento do tamanho da cadeia carbônica. Moléculas menores são gases à temperatura ambiente (metano, etano, propano e butano), enquanto que moléculas maiores são líquidos ou sólidos. A solubilidade em água é extremamente baixa devido à sua natureza apolar e à fraca interação com as moléculas de água polares.
As forças intermoleculares predominantes nos alcanos são as forças de van der Waals (forças de London), que aumentam com o tamanho da molécula, influenciando diretamente os pontos de ebulição e fusão. Moléculas maiores possuem maior área de superfície de contato, levando a forças de van der Waals mais intensas e, consequentemente, pontos de ebulição e fusão mais altos.
| Nome do Alcano | Fórmula Molecular | Ponto de Ebulição (°C) | Ponto de Fusão (°C) |
|---|---|---|---|
| Metano | CH₄ | -162 | -183 |
| Etano | C₂H₆ | -89 | -183 |
| Propano | C₃H₈ | -42 | -188 |
| Butano | C₄H₁₀ | -1 | -138 |
Propriedades Químicas dos Alcanos
Os alcanos são relativamente inertes devido à força das ligações C-C e C-H. Suas principais reações são a combustão e a halogenação. A combustão completa de um alcano produz dióxido de carbono e água, liberando uma grande quantidade de energia, sendo essa reação a base da utilização dos alcanos como combustíveis. A halogenação, por sua vez, envolve a substituição de átomos de hidrogênio por átomos de halogênio (como cloro ou bromo), geralmente na presença de luz ultravioleta.
Comparativamente a outros hidrocarbonetos, como alcenos e alcinos, os alcanos são menos reativos devido à ausência de ligações duplas ou triplas.
Esquema da combustão completa do metano:
CH₄ + 2O₂ → CO₂ + 2H₂O + calor
Nomenclatura dos Alcanos
A nomenclatura dos alcanos segue as regras da IUPAC (União Internacional de Química Pura e Aplicada). Para alcanos de cadeia linear, utiliza-se o prefixo que indica o número de átomos de carbono (met-, et-, prop-, but-, pent-, hex-, hept-, oct-, non-, dec-, etc.) seguido do sufixo -ano. Para alcanos ramificados, a cadeia principal é a mais longa, e as ramificações são nomeadas como grupos alquila (metil, etil, propil, etc.).
- Cadeia Linear: Butano (C₄H₁₀)
- Cadeia Ramificada: 2-metilpropano (C₄H₁₀)
A numeração da cadeia principal começa pela extremidade mais próxima da ramificação, garantindo os menores números possíveis para os localizadores das ramificações. Para alcanos com até 10 átomos de carbono, a aplicação dessas regras é relativamente simples.
Exemplos de Alcanos, Apresente As Principais Características Dos Alcanos E Forneça 2 Exemplos
| Nome do Alcano | Fórmula Estrutural | Fórmula Molecular | Aplicações |
|---|---|---|---|
| Metano | CH₄ | CH₄ | Combustível (gás natural), produção de hidrogênio. |
| Octano | CH₃(CH₂)₆CH₃ | C₈H₁₈ | Componente da gasolina, solvente. |
O metano é o principal componente do gás natural, amplamente utilizado como combustível residencial e industrial. O octano, por sua vez, é um componente importante da gasolina, contribuindo para o seu desempenho e propriedades de combustão.
Isomeria em Alcanos
A isomeria em alcanos ocorre principalmente como isomeria de cadeia, onde moléculas com a mesma fórmula molecular possuem diferentes arranjos de átomos de carbono na cadeia. A partir do butano (C₄H₁₀), observamos a existência de isômeros, como o butano (cadeia linear) e o metilpropano (cadeia ramificada). Essas diferenças estruturais levam a variações em suas propriedades físicas, como ponto de ebulição e ponto de fusão, enquanto as propriedades químicas permanecem semelhantes, uma vez que as ligações químicas são as mesmas.
O butano e o metilpropano, por exemplo, apresentam diferentes pontos de ebulição devido às diferentes formas de interação intermolecular. O butano, por ser linear, possui maior área de superfície de contato, levando a maiores forças de van der Waals e ponto de ebulição mais alto em comparação ao metilpropano, que é mais compacto.
Em resumo, a compreensão das características dos alcanos é fundamental para a química orgânica e suas aplicações industriais. Desde a combustão eficiente, geradora de energia, até a produção de plásticos e outros materiais, os alcanos desempenham um papel crucial na nossa sociedade. A relação entre estrutura, propriedades e reatividade desses compostos, estudada através de suas propriedades físicas, como ponto de ebulição e fusão, e reações químicas, como combustão e halogenação, nos permite entender melhor o seu comportamento e potencial de uso.
Aprofundar-se nesse tema é abrir portas para inovações em áreas como a produção de energia sustentável e o desenvolvimento de novos materiais, mostrando a importância do conhecimento científico na resolução de desafios contemporâneos. A exploração da isomeria, por exemplo, amplia ainda mais a gama de possibilidades e aplicações.

